Свойства терато-карциномных клеток. Эмбриональная плюрипотентная стволовая клетка
Большая часть терато-(эмбрио)-карциномных клеток в микроокружении нормальных эмбриональных клеток почти закономерно приобретает злокачественные неопластические характеристики. Считается, что необратимая малигнизация обусловлена активацией протоонкогенов в процессе структурных перестроек. Одним из исключений являются клетки эмбриокарциномной линии SST3, полученной из тератом мышиных семенников (линия 129/Sv-ter), которые проявляют высокую способность интегрироваться в ткани и органы зародыша без последующего образования опухолей у химерных мышей (Martin, Evans, 1975; Дыбан А., Дыбан 77., 2002).
Производные терато-(эмбрио)-карциномных клеточных линий у мышей-химер практически не принимают участия в образовании первичных гоноцитов. Очевидно, это связано с высокой частотой хромосомных аберраций, характерных для большинства терато-(эмбрио)-карциномных линий, в клетках которых наблюдается как анэуплоидия, так и хромосомные аномалии (lies, Evans, 1977).
В лабораторных условиях было получено несколько стабильных линий терато-(эмбрио)-карциномных клеток человека, характеризующихся плюрипотентностью, высокой пролиферативной активностью и способностью к дифференцировке при росте в культурах. В частности, линия терато-(эмбрио)-карциномных клеток человека NTERA-2 использовалась для изучения механизмов нейральной цитодифференцировки. После трансплантации клеток данной линии в субвентрикулярную область переднего мозга новорожденных крыс наблюдалась их миграция и нейроногенез.
Предпринимались даже попытки пересадки нейронов, полученных при культивировании клеток терато-(эмбрио)-карциномной линии NTERA-2, больным с инсультами, что, по мнению авторов, приводило к улучшению клинического течения заболевания. При этом случаев малигнизации трансплантированных клеток терато-(эмбрио)-карциномной линии NTERA-2 у пациентов с инсультом не отмечалось.
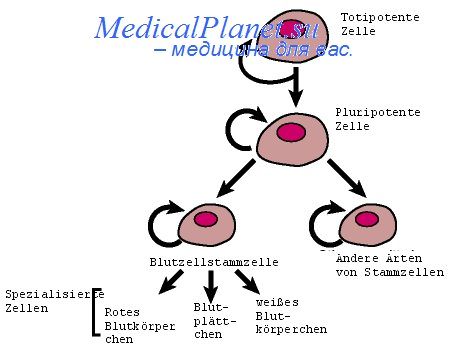
Первые линии недифференцированных плюрипотентных эмбриональных стволовых клеток мышей в начале 80-х годов прошлого века получили Эванс и Мартин, выделив их из внутренней клеточной массы бластоцисты — эмбриобласта (Evans, 1981; Martin, 1981). Выделенные линии ЭСК в течение длительного времени сохраняли плюрипотентность и способность дифференцироваться в различные типы клеток под воздействием факторов специальной среды культивирования (Evans, Kaufman, 1981; Martin, 1981; Deutschman, 1985).
Сам термин "эмбриональная плюрипотентная стволовая клетка" принадлежит Лерою Стивенсу, который при исследовании воздействия табачной смолы на частоту развития опухолей обратил внимание на спонтанное возникновение тестикулярной тератокарциномы у линейных (129/v) мышей контрольной группы. Клетки тератокарцином семенников отличались высокой скоростью пролиферации, а в присутствии жидкости из брюшной полости выходили в спонтанную дифференцировку с формированием нейронов, кератиноцитов, хондроцитов, кардиомиоцитов, а также волос и фрагментов костной ткани, но без каких-либо признаков упорядоченной цитоархитектоники соответствующей ткани.
При высадке в культуру клетки тератокарцином росли неприкрепленными к подложке плюрипотентными клонами и формировали эмбриоидные тельца, после чего прекращали деление и подвергались спонтанной беспорядочной дифференцировке в нейроны, глию, мышечные клетки и кардиомиоциты. Стивенс установил, что тератокарцинома мышей 129/v содержит менее 1% клеток, способных дифференцироваться в разнообразные специализированные соматические линии, а сама дифференциация зависит от факторов, которые на них воздействуют (состав жидкости брюшной полости, продукты добавленных в культуру зрелых клеток или тканей).
Предположение Лероя Стивенсона о наличии среди клеток тератокарциномы эмбриональных прогениторных клеток полового зачатка подтвердилось: суспензия клеток эмбриобласта доимплантационных зародышей в тканях взрослых мышей формировала тератокарциномы, а выделенные из них чистые клеточные линии после интраперитонеального введения животным-реципиентам дифференцировались в нейроны, кардиомиоциты и другие соматические клетки-производные всех трех зародышевых листков (Lewis, 2000; Репин, 2001). В экспериментах in vivo трансплантация ЭСК (полученных из эмбриобласта, но не трофобласта) в зародыши мыши иной линии на стадиях 8-32 бластомер заканчивалась рождением химерных животных (без возникновения опухолей), в органах которых обнаруживались ростки донорской ткани. Химеризм наблюдался даже в линии половых клеток (Bradley, 1984).
- Читать далее "Свойства эмбриональных стволовых клеток. Источники эмбриональной стволовой клетки"
Оглавление темы "Эмбриональные стволовые клетки":1. Стромальные стволовые клетки. Мезенхимальные стволовые клетки
2. Стволовые клетки в неврологии. Онкогенность стволовых клеток
3. Стоимость регенеративно-пластической медицины. Тотипотентность стволовых клеток
4. Эволюция тотипотентности. Особенности тотипотентности растений
5. Стволовые клетки растений. Тотипотентность генома человека
6. Эмбриональные клетки. Терато-карциномные клетки человека
7. Свойства терато-карциномных клеток. Эмбриональная плюрипотентная стволовая клетка
8. Свойства эмбриональных стволовых клеток. Источники эмбриональной стволовой клетки
9. Клеточные линии эмбриональной стволовой клетки. Первичные половые клетки
10. Сходство стволовых клеток и первичных половых клеток. Эмбриональные половые клетки

